
DNA HEALTH
Las diferencias genéticas nos hacen únicos. La información del perfil genético puede usarse para estimar la probabilidad de desarrollar una enfermedad. Con la identificación de cambios puntuales en las secuencias de genes específicos - llamados polimorfismos- y una evaluación precisa de riesgo genético, se pueden establecer medidas preventivas que aborden factores de riesgo ambientales modificables para evitar así una enfermedad y fortalecer su salud. La prueba DNA Health se compara a un "manual de usuario" ya que ayuda a entender el funcionamiento del cuerpo y sólo se necesita hacer una vez en la vida.
Un polimorfismo genético se refiere a la aparición simultánea de alelos (formas alternativas de un gen) en la población que muestran variaciones en una posición determinada. La definición original se aplicaba a alelos que producían diferentes fenotipos (como el color de ojos) pero hoy también se usa para describir cambios en el DNA que afectan el patrón de restricción o incluso la secuencia. Para ser considerado como ejemplo de polimorfismo, un alero debería encontrarse con una frecuencia mayor de 1% en la población1. También son llamados SNP (Single nucleotide polymorphism).
Los polimorfismos han sido estudiados en detalle, y correlacionados con el riesgo de que el individuo que los tenga, podría o no desarrollar ciertas enfermedades crónicas o procesos metabólicos alterados. La prueba genética DNA Health identifica la presencia o ausencia de estos polimorfismos y en función de ello determina el "riesgo genético". Se analizan 58 SNPs de 44 genes específicos, cuyos productos las proteínas, participan en procesos biológicos claves como: metabolismo lipídico, salud ósea, metilación, desintoxicación, inflamación, estrés oxidativo y sensibilidad a la insulina. También se evalúa la sensibilidad alimentaria a través de genes implicados en sobrecarga de hierro, intolerancia a la lactosa, metabolismo de los ácidos grasos poliinsaturados (PUFA), sensibilidad a la sal, sensibilidad de la respuesta al sabor amargo y el metabolismo del alcohol. Y como plus, se analizan la intolerancia al gluten a través de DQ2/DQ8 y las variantes genéticas más importantes del metabolismo de las vitaminas A, C, D y B12. El estudio de todas estas áreas particulares hace una evaluación realmente integral del riesgo genético para la salud. En conjunto deben considerarse con el perfil genético los factores ambientales que lo acompañan, como son la dieta y el estilo de vida.
Los estudios genéticos -analítica de precisión- además de identificar a las personas con mayor riesgo de desarrollar una determinada enfermedad o de tener manifestaciones más graves, aportan una gran contribución a la medicina de precisión porque ayudan a dirigir un tratamiento personalizado y eficaz y sobre todo a establecer cambios del estilo de vida para prevenir la aparición de la enfermedad 2.
Por ejemplo, en los accidentes cerebrovasculares y las enfermedades coronarias tanto los factores de riesgo ambientales como genéticos aumentan el riesgo de desarrollar estas enfermedades, sin embargo los factores ambientales tienen a veces una influencia mayor que los factores de riesgo genéticos 3,4.
Los factores de riesgo genéticos no se pueden modificar, pero los factores de riesgo del ambiente sí, de modo que los cambios en el estilo de vida son de mucha utilidad en la prevención de una enfermedad. Un estudio con familiares de primer grado de pacientes con artritis reumatoide hizo hincapié en esto, difundiéndoles información sobre el riesgo genético lo que condujo a modificaciones positivas en su comportamiento como dejar de fumar y tener una mejor higiene dental, los cuales son factores de riesgo ambientales asociados para el desarrollo de la enfermedad 5.
En VitâgeLab estamos convencidos que los cambios de conductas son muy importantes para mitigar el riesgo genético y ponemos a su disposición avanzadas pruebas para que sepa cuál es su score de riesgo genético y pueda prevenir enfermedades. VitâgeLab de esta manera contribuye personalizadamente a mejorar su calidad de vida. Los resultados de las pruebas genéticas pueden ser difíciles de entender, no obstante, la forma en la que VitâgeLab elabora y presenta sus resultados le ayuda tanto a Usted como a su médico a entenderlos fácil y claramente. Nuestro objetivo es hacer que la ciencia sea fácilmente accesible para toda la práctica clínica.
VitâgeLab recomienda esta prueba genética junto con el Perfil Longevity 360 que es un exhaustivo análisis del funcionalismo del cuerpo. Estas dos pruebas constituyen un verdadero "escáner genético y bioquímico" del organismo, alertando sobre los eventuales cambios en el estilo de vida que una persona tendría que hacer para prevenir enfermedades y así alcanzar una mejor calidad de vida y bienestar.
En la siguiente tabla se resumen las áreas biológicas, los genes y el polimorfismo, SNP o variación genética que se analizan. La nomenclatura del polimorfismo debe interpretarse de la siguiente manera: por ejemplo 345 A>T, donde 345 es la posición en la cadena de DNA donde A (adenina) fue sustiuída por T (timina). Algunas veces las sustituciones pueden causar un impacto benéfico para el organismo y otras veces sucede todo lo contario.
| Area Biológica | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Gen | SNP | Función | ||||||||||||
| Metabolismo Lipídico | ||||||||||||||
| La salud del miocardio depende de un equilibrio complejo de factores ambientales, dietéticos y genéticos. Ciertos genes influyen en el LDL y niveles de colesterol HDL; los niveles más altos de LDL o colesterol "malo" y los niveles más bajos de HDL o colesterol "bueno" son asociado con un mayor riesgo de enfermedad cardíaca. | ||||||||||||||
|
Lipoproteinlipasa (LPL) |
1595 C>G | Enzima clave en el metabolismo de los triglicéridos. Juega un papel importante en la eliminación de lípidos del torrente sanguíneo, la utilización y el almacenamiento de los lípidos. Media la marginación de las partículas de lipoproteínas ricas en triglicéridos en los capilares. En la variante 1595 C> G La actividad de LPL es mayor, y este aumento en el metabolismo de las lipoproteínas conduce a una reducción en los triglicéridos, un aumento en el HDL y una resistencia posterior a las enfermedades del corazón. | ||||||||||||
| Proteína de transferencia de ésteres de colesterol (CETP) | 279 G>A | La proteína CETP regula el colesterol HDL. El HDL-C muestra un efecto protector contra el desarrollo de la aterosclerosis. EL alello G279 (alelo B1) está asociado con una mayor actividad de CETP y una menor concentración HDL-C, por lo tanto, puede ser responsable del desarrollo de enfermedades del sistema cardiovascular como aterosclerosis. En cambio, el alelo A279 (alelo B2) está asociado con menor actividad CETP y mayor valor de colesterol HDL. | ||||||||||||
| Apolipoprotein lipasa C-III (APOC3) | 3175 C>G | La apolipoproteína C3 juega un papel importante en en la homeostasis de triglicéridos. Es un componente de las lipoproteínas de muy baja densidad (VLDL) ricas en triglicéridos y HDL-C. Inhibe a la LPL y a la lipasa hepática retrasando el catabolismo de las VLDL. El alelo G está asociado con niveles elevados de triglicéridos, colesterol y APOC3 y sus portadores tienen 4 veces más riesgo de hipertrigliceridemia. | ||||||||||||
| Apolipoproteína (APOE) | E2/E3/E4 | APOE desempeña un papel fundamental en la homeostasis lipídica plasmática y tisular y en el transporte de lípidos en el SNC. Hay tres alelos APOE comunes: E2, E3 y E4. El alelo más frecuente en la población humana es E3. Las personas que portan la variante E4 tienen mayor riesgo de enfermedades cardiovasculares, debido a niveles más altos de colesterol total y LDL. Los portadores E4 son hipersensibles al alcohol y a fumar, así como a las grasas de la dieta y tienen un mayor requerimiento antioxidante. Además, el alelo E4 está asociado con las formas familiares y esporádicas comunes de enfermedad de Alzheimer de inicio tardío. Hidroliza los metabolitos tóxicos de insecticidas organofosforados. Media una protección enzimática de las lipoproteínas de baja densidad contra la oxidación y la consiguiente serie de eventos que conducen a la formación de ateroma. |
||||||||||||
| Paraoxonasa sérica / arilesterasa 1 (PON1) | rs 662 A>G Q 192 R |
La baja actividad de PON 1 se ha asociado con mayor riesgo de enfermedad coronaria y trasorno de ansiedad. El alelo (A) codifica una glutamina (Q), mientras que la variante (G) codifica una arginina (R). La proteína PON1 que contiene glutamina tiene una mayor actividad enzimática, lo que lleva a un menor riesgo de enfermedad cardíaca. Mientras que la proteína con arginina o el alelo G se asocian con menores concentraciones y actividad de PON1 y por lo tanto con un mayor riesgo de aterosclerosis y ciertos tipos de cáncer como el de ovario. | ||||||||||||
| Metilación | ||||||||||||||
|
El proceso biológico de metilación o agregados de grupos metilo (-CH3) es muy importante y puede tener lugar tanto a nivel de DNA como de proteínas. La metilación del DNA se lleva a cabo en las Citocinas (C) y es fundamental en la regulación del silenciamiento génico ya que puede provocar alteraciones en la transcripción genética sin necesidad de una alteración en la secuencia del ADN; a esto se le conoce como mecanismo epigenético. Además las histonas pueden ser metiladas, acetiladas o fosforiladas controlando así tambien la expresión de los genes. La acetilación está relacionada con la activación génica mientras que la metilación de histonas se vincula con la inactivación. También son metiladas otras proteínas regulándose así su función. En este proceso intervienen enzimas llamadas metiltransferasas que necesitan vitaminas B como cofactores. La metilación también es fundamental en el metabolismo de la metionina donde las vitaminas B6, B12 son donadoras de -CH3 y donde se obtiene homocisteína (Hcy) como metabolito tóxico. Si hay alteración en las enzimas o en los cofactores (B12, B6, ácido fólico) de esta vía metabólica habrá homocistinemia. Durante la autoxidación de Hcy se generan especies reactivas del oxígeno, como son el anión superóxido, peróxido de hidrógeno y el anión hidroxilo, los que a su vez pueden provocar disfunción endotelial llevando a daño de la pared vascular con graves consecuencias (regulación vasomotora alterada, cambio del fenotipo antitrombótico, activación y agregación plaquetaria, activación de la elastasa y aumento de la deposición de Ca2+ en la íntima arterial) y peroxidación de los lípidos de las LDL con formación de hidroxicolesteroles con los consiguientes efectos citotóxicos y aterogénicos. Además, el óxido nítrico (NO), en presencia de oxígeno, reacciona con el grupo sulfhidrilo de la homocisteína formando S-nitroso homocisteína que provoca aún más daño oxidativo y bloquea el efecto vasodilatador del NO. Una deficiencia en los folatos celulares (miembros de la familia de las vitaminas B9) y los donantes de metilo puede estar asociada con metilación anormal del ADN, roturas de la cadena del ADN, recombinación cromosómica defectuosa y segregación cromosómica anormal. El ciclo del folato está involucrado, además del ciclo de metionina, con un proceso fisiológico esencial: la síntesis de purinas y pirimidinas requeridas para la síntesis y reparación del ADN. Los niveles más bajos de ácido fólico se han asociado con un mayor riesgo de trisomía 21 y, por lo tanto, la ingesta suplementaria de ácido fólico ahora se recomienda comúnmente durante la pre y post concepción y el embarazo temprano. |
||||||||||||||
|
Metilenetetrahidrofolato deshidrogenasa MTHFD1 |
rs2236225 1958 G>A Arg653Gln |
MTHFD1 codifica para la metilenetetrahidrofolato deshidrogenasa, que es una enzima involucrada en el metabolismo del folato que tiene tres diferentes actividades enzimáticas; 5,10-metilentetrahidrofolato deshidrogenasa, ciclohidrolasa y sintetasa donde se generan sustratos para la síntesis de metionina, y para la biosíntesis de novo de purina y pirimidina y, por lo tanto, para la biosíntesis de ADN. Variantes que afectan el metabolismo de folato predicen la susceptibilidad a la deficiencia de colina, un nutriente esencial, participa además del metabolismo de homocisteína, en la síntesis de neurotransmisores, vias señalización a través de la membrana celular y en el transporte de bilis y lipoproteínas6. En el tejido extrahepático, el folato es el responsable de la remetilación de la homocisteína a metionina generando el donante de metilo S-adenosilmetionina (SAM). Sin embargo, en el hígado, tanto el folato como la betaína, forma oxidada de la colina, contribuyen a la biosíntesis de metionina. Una mayor contribución de la betaína a la biosíntesis de metionina puede ahorrar cofactores de folato para la síntesis de nucleótidos. El polimorfismo rs 2236225, 1958 G>A (Arg653Gln) reduce la actividad de a enzima en alrededor un 50% lo que favorece se desvíe la vía a la biosíntesis de timidilato, a expensas de la remetilación de la homocisteína dependiente de folato. Este SNP se ha asociado con un mayor riesgo de defectos del tubo neural7, defectos cardíacos congénitos y pérdida inexplicable del embarazo en el segundo semestre. Además, los portadores de alelos (A) desarrollan signos de deficiencia de colina y disfunción orgánica (hígado y músculo) en comparación con aquellos con el genotipo GG. Las personas con el genotipo AA pueden requerir una mayor ingesta de alimentos ricos en colina o sus suplementos. |
||||||||||||
|
Metilenetetrahidro folato reductasa (MTHFR) |
1298 A>C 677 C>T |
Cataliza la conversión de 5,10-metilenetetrahidrofolato a 5-metiltetrahidrofolato, un cosustrato para la remetilación de homocisteína en metionina. El polimorfismo A1298C tiene un efecto menor en la reducción de la actividad enzimática, en comparación con la mutación 677. La variante 1298 A> C confiere un mayor riesgo de aterosclerosis subclínica y eventos cardiovasculares, sobre todo en personas con artritis reumatoidea. El polimorfismo C677T es factor de riesgo de enfermedades cardiovasculares en la población general. Las mujeres con dos variantes del gen C677T tienen un mayor riesgo de tener un hijo con un defecto del tubo neural, y tromboembolismo venoso al igual que los hombres. Además, las variaciones genéticas influyen en la susceptibilidad a cáncer de colon y páncreas ( C677T) y leucemia aguda. |
||||||||||||
| Metionina sintasa (MTR) |
2756 A>G (Asp919Gly) |
MTR cataliza el paso decisivo para la remetilación de la Hcy para formar metionina. La influencia de MTR 2756A> G en los niveles plasmáticos de homocisteína total sigue siendo un tema de debate. Algunos estudios informaron que este polimorfismo tuvo un efecto en el aumento de la concentración de Hcy en presencia del alelo común A, mientras que en otros se observó una asociación entre Hcy elevada y el alelo G. La deficiencia de la actividad de la metionina sintasa produce hiperhomocisteinemia, homocistinuria y anemia megaloblástica sin aciduria metilmalónica. Niveles elevados de Hcy se correlacionan con enfermedades cardiovasculares, defectos del tubo neural y enfermedad de Alzheimer; además 2756AG está asociado con el aumento de las concentraciones plasmáticas de Hcy en pacientes con Sindrome de Down. | ||||||||||||
| Metionina Sintasa Reductasa (MTRR) |
66 A>G (Ile22Met) |
MTRR es responsable de activar la Metionina Sintasa a través de la metilación reductora que modula una deficiencia funcional de la metionina sintasa cuando la actividad de MTRR se interrumpe. El polimorfismo A66G compromete potencialmente la actividad de MTR que conduce a niveles elevados de Hcy. El alelo G está asociado con riesgo de enfermedades coronarias. También las variantes de los genes de Metionina Sintasa (MTR) A2756G y Metionina Sintasa Reductasa (MTRR) A66G,en mujeres, influyen en el riesgo de tener un hijo con espina bífida y otros defectos del tubo neural. | ||||||||||||
|
Cistationina beta-sintasa (CBS) |
699C>T |
La CBS cataliza la conversión de homocisteína a cIstationina y está involucrada en la eliminación de la toxica homocisteína en el ciclo de la metionina, por lo que cualquier alteración en su actividad podría afectar los niveles de homocisteína. Esta enzima usa la vitamina B6 como cofactor. También participa en la producción de sulfuro de hidrógeno, un gasotransmisor con señalización y efectos citoprotectores en las neuronas. La variante 699T está asociada con una disminución del riesgo de enfermedad coronaria y una mayor capacidad de respuesta a la disminución de la homocisteína por el ácido fólico. |
||||||||||||
| Catecol O-metiltransferasa (COMT) | 472 G>A Val 158Met |
La Catecol O-metiltransferasa cataliza la O-metilación y, por lo tanto, la inactivación de neurotransmisores de catecolaminas y hormonas catecol usando Mg como cofactor. Se hace referencia a los dos alelos como Val (G) y Met (A). El alelo G codifica una enzima termoestable y con alta actividad y el alelo A codifica una COMT termolábil de baja actividad. El polimorfismo funcional 472G A es factor de riesgo para varios trastornos como esquizofrenia,trastorno por déficit de atención con hiperactividad, autismo, abuso de drogas y trastorno de estrés postraumático. |
||||||||||||
| Inflamación | ||||||||||||||
| La inflamación es una respuesta inmune normal y esencial en la curación de los tejidos. Pero cuando la respuesta inflamatoria es prolongada se cronifica ocasionando un daño tisular. Un número creciente de trastornos comunes, como la obesidad, las enfermedades cardíacas, enfermedads autoinmunes, la aterosclerosis, la artritis y la enfermedad inflamatoria intestinal y hasta el cáncer se han asociado con inflamación crónica. | ||||||||||||||
|
Interleucina 6 (IL-6) |
-174 G>C | Esta citocina es un potente inductor de la respuesta de fase aguda. Desempeña un papel esencial en la diferenciación final de linfocitos B y de las células nerviosas. También actúa como mioquina, se descarga en el torrente sanguíneo después de la contracción muscular y actúa para aumentar la descomposición de las grasas y mejorar la resistencia a la insulina. La liberación excesiva e IL-6 puede conducir a un estado inflamatorio crónico. El alelo C ha sido asociado con aumento de IL-6 y PCR; también con inflamación, obesidad, resistencia a la insulina, dislipidemia y aumento de la presión sanguínea. | ||||||||||||
|
Factor de Necrosis Tumoral α (TNFA) |
-308 G>A | El TNF-α es una citocina proinflamatoria principalmente secretada por los macrófagos y puede inducir la muerte celular de ciertas líneas celulares tumorales. Es un pirógeno potente que causa fiebre por acción directa o por estimulación de la secreción de interleucina-1 y está implicada en la inducción de la caquexia. Induce la resistencia a la insulina en los adipocitos mediante la inhibición de la fosforilación de IRS1,la cual es inducida por la insulina. Induce la degradación de la proteína GKAP42 en los adipocitos, que es parcialmente responsable de la resistencia a la insulina. El alelo A del TNF-α está vinculado a niveles más altos de TNF-α y CRP y con un riesgo incrementado para obesidad, dislipidemia y resistencia a la insulina. | ||||||||||||
|
Interleucina 1 (IL-1) |
IL-1A4845 G>T IL-1A -889 C>T IL-1B 3954 C>T IL-1B-511 A>G IL1RN2018C>T |
La familia de genes IL-1 consta de dos moléculas agonistas principales IL-1α e IL-1β, y una citocina antagonista, el antagonista del receptor de IL-1 (IL-1Ra). Tanto IL-1α como IL-1β son producidas por linfocitos o monocitos. Las proteínas IL-1 están involucradas en la respuesta inflamatoria, identificándose como pirógenos endógenos y estimulan la liberación de prostaglandina y colagenasa de las células sinoviales. Ciertas variaciones genéticas en IL-1A, IL-B e IL-1 RN conducen a una respuesta inflamatoria más activa y se han asociado con un mayor riesgo para enfermedades crónicas. Para IL 1α el genotipo -889TT favorece la transcripción del gen mientras que los SNP en C-889T y 4845,participan en el desarrollo de la obesidad y se han asociado con un aumento en el índice de masa corporal en mujeres. Además, la actividad del promotor de IL-1α es mayor en aquellos individuos que muestran el genotipo TT -889 sobre el genotipo CC -889. En el gen IL-1B 3954C>T podría ser un factor de riesgo para periodontitis crónica y se cree puede ser un marcador de la destrucción articular en la Artritis Reumatoide. Además está asociado con un desequilibrio en la producción de IL-1Ra. El equilibrio entre la interleucina-1 (IL-1) y su antagonista competitivo del receptor de IL-1 (IL-1Ra) puede contribuir a la patogénesis de (AR). Para IL-1RN 2018C>T se ha relacionado con un aumento en la producción de IL-1Ra en pacientes diabéticos. | ||||||||||||
| Estrés Oxidativo | ||||||||||||||
| Los radicales libres (RL) son un subproducto de los procesos bioquímicos energéticos del cuerpo. Son altamente reactivos y pueden dañar el ADN, las proteínas y las membranas celulares. Las células cuentan con mecanismos antioxidantes que los inactivan como, el glutatión, la superóxido dismutasa, la catalasa y la glutatión peroxidasa. Antioxidantes exógenos son la vitamina E, la vitamina C, el beta caroteno, los flavonoides y el licopeno. Se llama estrés oxidativo cuando las defensas antioxidantes son sobrepasadas por las fuerzas oxidantes. El estrés oxidativo se relaciona con el envejecimiento y la carcinogénesis. | ||||||||||||||
| Sintasa Endotelial de Oxido Nítrico (eNOS) | G> T | Está implicada en la relajación del músculo liso vascular a través de la producción del óxido nítrico (NO). El NO media la angiogénesis en los vasos coronarios y promueve la coagulación de la sangre a través de la activación de las plaquetas. La disminución de la actividad de esta enzima, como se observa en individuos con el alelo T, se asocia con un aumento de los radicales libres y el estrés oxidativo. | ||||||||||||
|
Superóxido Dismutasa 2 (MnSOD/SOD2) |
28 C>T | Es una enzima antioxidante mitocondrial. Destruye los radicales anión superóxido que son tóxicos para los sistemas biológicos. El entrenamiento intensivo produce estrés oxidativo y esta enzima es muy importantes para minimizar la fatiga muscular. El alelo C está relacionado con niveles más altos de estrés oxidativo. | ||||||||||||
|
Catalasa (CAT) |
262 C>T |
La catalasa protege a las células de los efectos tóxicos del peróxido de hidrógeno. Se expresa en el hígado, los riñones y los eritrocitos. La disminución de la actividad de CAT conduce a mayores concentraciones de peróxido de hidrógeno, lo que lleva a un mayor estrés oxidativo. Los individuos que portan el alelo C se han asociado con una disminución del riesgo de cáncer y mejor equilibrio antioxidante. El genotipo TT de la catalasa es más frecuente en personas asmáticas. |
||||||||||||
|
Glutatión peroxidasa 1 (GPX1) |
C>T (Pro198Leu) |
GPx1 es la más abundante de las enzimas selenoperoxidasas, y es responsable de catalizar la coonversión del peróxido de hidrógeno en agua, así como de reducir los hidroperóxidos de ácidos grasos y el peroxinitrito utilizando glutatión como sustrato; por lo tanto ayuda a mantener el equilibrio redox. El genotipo CT se ha relacionado con un equilibrio antioxidante alterado y se ha asociado con un mayor riesgo de enfermedades crónicas, como las cardiovasculares y ciertos tipos de cáncer, especialmente cuando la ingesta de frutas y verduras es baja. Un estudio mostró que la actividad GPx-1, combinada con la homocisteína, podría predecir el riesgo cardiovascular. Además, se sugirió que el nivel GPx-1 es un marcador valioso para monitorear los eventos cardiovasculares. |
||||||||||||
| Salud Ósea | ||||||||||||||
| Los huesos se remodelan continuamente y tanto la nutrición como los factores genéticos juegan un papel importante en la salud ósea. Después de los 30 años, tanto hombres como mujeres comienzan a perder masa ósea y la pérdida es particularmente marcada en las mujeres después de la menopausia. | ||||||||||||||
|
Receptor nuclear de calcitriol (VDR) |
Rs 2228570 Fok1 T>C Rs1544410 Bsm1 G>A Rs731236 Taq1 C>T |
La forma activa de vitamina D3 desempeña un papel central en la homeostasis del calcio. La vitamina D3 inhibe la expresión de renina en el aparato yuxtaglomerular y la proliferación de las células vasculares del músculo liso. Tiene un papel crítico en la regulación del sistema renina-angiotensina que influye en la regulación de la presión arterial. Los receptores de vitamina D están presentes en las células endoteliales aórticas y vasculares del músculo liso y por eso los polimorfismos del VDR influyen en la susceptibilidad a las enfermedades cardiovasculares. El polimorfismo Fok I está asociado con el riesgo de desarrollar hipertensión esencial. Por lo tanto, la deficiencia de vitamina D puede aumentar el riesgo de hipertensión, y la suplementación con vitamina D puede ser beneficiosa para el sistema cardiovascular. El alelo T de la variante Fok1 (VDRff) se relaciona con una menor capacidad de absorción de calcio que el alelo C (variante VDRFF). Además, la variante VDRFF es más eficaz en la supresión de la vía de señalización del receptor de estrógenos y otras vías proinflamatorias en las células de cáncer de mama por lo que se ha sugerido que la variante Fok1 es un factor de susceptibilidad para los cánceres de mama y de ovario. La variante Bsm1 (BaT) o alelo A está asociada con una disminución de la densidad mineral ósea y predispone a la osteoporosis. Además, las variantes Fok1 y Bsm1 pueden influir en la susceptibilidad a desarrollar melanoma. La variante Taq1 se asoció con una disminución del riesgo de cáncer de próstata (pero no de cáncer colorrectal, de seno u ovario). | ||||||||||||
|
Colágeno tipo I (COL1A1) |
1546 G>T | Es uno de los colágenos principales del tejido conectivo. Forma las fibrillas de tendones, ligamentos y huesos. En los huesos, las fibrillas se mineralizan con hidroxiapatita de calcio. La expresión alterada de este gen puede conducir a riesgo de lesiones debido a un cambio estructural en las propiedades del tejido. El alelo T COL1A1 lleva a una mineralización anormal del hueso y una resistencia ósea reducida con mayor riesgo de fracturas sobre todo cuando la calcemia es baja. | ||||||||||||
| Desintoxicación | ||||||||||||||
| La fase I neutraliza las toxinas o los productos químicos no deseados convirtiéndolos en formas intermedias más activas químicamente y que son procesadas por los enzimas de la fase II. La detoxificación de la fase I implica la participación de enzimas que en su conjunto se denominan como citocromo P450 y cuya actividad varía de un individuo a otro según su genética, exposición a las toxinas y su estado alimenticio. El efecto secundario de esta fase, es la producción de radicales libres que gracias a los sistemas de defensas antioxidantes evitan el daño tisular. El antioxidante más importante es el glutatión (GSH) que se oxida a disulfuro de glutatión (GSSG) 8. Las enzimas de la fase II actúan sobre las toxinas activadas en la fase I lo que las hace más solubles y se excretan más fácilmente a través del sudor y la orina. Existen esencialmente 6 vías: 1)Conjugación con Glutatión, 2)Conjugación con aminoácidos, 3)Sulfatación, 4)Glucuronidación, 5)Metilación y 6)Acetilación. Una disfunción mitocondrial, un déficit de cofactores como magnesio o vitamina B6 y una inactividad física pueden provocar un enlentecimiento de la Fase II y el consiguiente aumento de las sustancias intermediarias tóxicas. Los individuos con una Fase I muy activa y con una Fase II lenta son detoxificadores patológicos. El funcionamiento apropiado de los sistemas de detoxificación del hígado es especialmente importante para la prevención del cáncer. | ||||||||||||||
| CYP1A1 |
Msp1 T >C Ile462Val A>G |
El gen CYP1A1 codifica para la enzima citocromo P450, de la fase I de desintoxicación, implicada en el metabolismo de varios sustratos endógenos, incluidos los ácidos grasos, las hormonas esteroides, las vitaminas y procarcinógenos ambientales. Exhibe una alta actividad catalítica para la formación de hidroxiestrógenos a partir de estrona (E1) y 17beta-estradiol (E2). El riesgo de cánceres inducidos por estrógenos (cáncer de mama y próstata) y enfermedades cardiovasculares podría estar determinado, al menos parcialmente, por sus variantes genotípicas. Puntualmente, el polimorfismo MspI está asociados con un mayor riesgo de cáncer de pulmón. | ||||||||||||
|
Glutatión S-transferasa Mu 1 (GSTM1) |
Inserción/Deleción | El gen GSTM1 codifica la glutatión S-transferasa M1, el miembro más activo de la superfamilia GST. La GSTM1 está involucrada en la Fase II de desintoxicación. Es responsable de la eliminación de xenobióticos, toxinas, carcinógenos y productos de estrés oxidativo. Un gran porcentaje de la población presenta una deleción de una o incluso ambas copias de este gen, lo que lleva a la ausencia de la enzima y a una capacidad reducida de desintoxicación hepática con mayor riesgo de cáncer, sensibilidad química, enfermedades cardiovasculares y en fumadores, asma atópica y déficit de la función pulmonar; especialmente si les faltan también copias de otros genes de la familia GST como GSTP1 o GSTT1. A estas personas se les recomienda una dieta rica en antioxidantes y minimizar la exposición a toxinas. | ||||||||||||
|
Glutatión S-transferasa P (GSTP1) |
313 A>G |
GSTP1 es el subtipo de GST más abundante en los pulmones y metaboliza muchos compuestos cancerígenos. La enzima GSTP1 tiene un impacto en el desarrollo y pronóstico de enfermedades influenciadas por el estrés oxidativo. El alelo G disminuye la actividad de la enzima siendo alrededor del 80% para los portadores de un alelo G, y el 70% para los genotipos GG. Además este polimorfismo se ha relacionado con la aparición de novo de síndromes mielodisplásicos. |
||||||||||||
|
Glutatión S-transferasa theta 1 (GSTT1) |
Inserción/Deleción | GSTT1 es un miembro de la superfamilia de proteínas que catalizan la conjugación de glutatión reducido a una variedad de compuestos electrofílicos e hidrófobos. Se expresa a bajos niveles en el hígado, en pulmón y en células ciliadas en la unión alveolar / bronquiolar. El gen GSTT1 está ausente en el 38% de la población y esta deleción está asociada con un mayor riesgo de cáncer de pulmón, laringe y vejiga, así como con carcinomas basales de la piel. | ||||||||||||
|
NADP(H)quinona oxidorreductasa1 (NQO1) |
C>T Pro187Ser |
NQO1 está involucrada principalmente en la desintoxicación de carcinógenos derivados del humo del tabaco, la dieta y del metabolismo del estrógeno. Además, NQO1 está involucrada en la protección contra el estrés oxidativo al mantener las formas antioxidantes de la ubiquinona y de la vitamina E. El polimorfismo C609T (Pro187Ser) está relacionado con la susceptibilidad a cáncer de pulmón, de seno, colorrectal y a la enfermedad de Parkinson. |
||||||||||||
| Sensibilidad a la insulina | ||||||||||||||
| La insulina es una hormona que estimula la absorción de glucosa en las células. Individuos con sensibilidad disminuida a la insulina tiene una capacidad limitada para responder a la acción de la hormona. La insensibilidad a la insulina o la resistencia de los tejidos periféricos ha sido implicada como un componente patogénico importante de la diabetes mellitus, la obesidad y el síndrome metabólico. | ||||||||||||||
|
Receptor de peroxisoma-proliferador-activado gamma (PPARG) |
Rs 1801282 C > G Pro12Ala |
El PPARγ es un factor de transcripción que tiene un papel importante en la adipogénesis. Una vez activado, el receptor nuclear se une a los elementos de respuesta PPAR específicos de ADN (PPRE) y modula la transcripción de sus genes diana, como la acil-CoA oxidasa. Por lo tanto, controla la vía de oxidación beta peroxisomal de los ácidos grasos. Es un regulador clave de la homeostasis de glucosa, de la sensibilidad a la insulina y de la homeostasis intestinal al suprimir las respuestas proinflamatorias mediadas por NF-kB. Las tiazolidinedionas, medicamentos para la diabetes mellitus tipo 2, se unen a PPARγ que al ser activado, media la transcripción de un número específico de genes mejorando la sensibilidad a la insulina. El alelo G del PPARγ está asociado con una reducida actividad transcripcional y de diferenciación de adipocitos, con una menor insulinemia en ayunas, una mejor sensibilidad a la insulina y un menor riesgo de resistencia a la insulina y diabetes. Los defectos en PPARγ pueden conducir a diabetes tipo 2, resistencia a la insulina e hiptertensión. Otras variates genotípicas de PPARγ pueden estan asociadas con el cáncer de colon. |
||||||||||||
|
Factor de transcripción 7-like 2 (TCF7L2) |
rs7903146 C>T |
El gen TCFL2 codifica un factor de transcripción que regula la homeostasis de la glucosa en sangre. El alelo T se ha asociado con un aumento de riesgo de resistencia a la insulina y diabetes mellitus tipo 2, especialmente en individuos obesos y con bajo HDL-C. También se lo ha asociado con menos pérdida de peso en respuesta a dieta. |
||||||||||||
|
Transportador de glucosa tipo 2 (SLC2A2) |
Thr110Ile |
Este gen codifica GLUT2 una glucoproteína integral de la membrana plasmática del hígado, las células β de los islotes pancráticos, el intestino y el epitelio renal, que facilita el transporte bidireccional de glucosa. Debido a su baja afinidad por la glucosa, se ha sugerido como un sensor de la misma y es de importancia en el estado posprandial y participa en la ingesta y regulación de alimentos. La variante Thr110Ile está asociada con el riesgo de diabetes tipo 2. Personas portadoras de este SNP tienen mayor consumo diario de ingesta de azúcares de dulces, como productos horneados, chocolate, y bebidas azucaradas, en lugar de frutas. |
||||||||||||
|
Gen asociado a la masa grasa y a la obesidad (FTO) |
Rs 9939609 T > A |
El gen asociado a la masa grasa y la obesidad (FTO) está expresado en tejidos metabólicamente activos como corazón, riñón y tejido adiposo y aumenta más su expresión en el cerebro, particularmente en el hipotálamo el cual se relaciona con regulación del apetito, temperatura, funciones autónomas y sistemas endócrinos. Se ha sugerido por lo tanto que el gen FTO juega un papel en la regulación del apetito y que está asociado con el gasto de energía. El alelo A se relaciona con un IMC más alto, mayor porcentaje de grasa corporal y circunferencia de la cintura, especialmente en individuos con un estilo de vida sedentario. Las personas con sobrepeso con el alelo A tienen mayor riesgo de resistencia a la insulina y diabetes, especialmente cuando hay un alto consumo de grasas. |
||||||||||||
| Sensibilidad alimentaria | ||||||||||||||
| Ciertos nutrientes y componentes puntuales de alimentos pueden afectar a las personas de diferentes maneras. Actualmente se pueden analizar genes específicos para tener una idea más clara de cómo podría responder un individuo a un componente alimenticio particular. | ||||||||||||||
| Sobrecarga de hierro | ||||||||||||||
|
Regulador homeostático del hierro (HFE) |
|
El gen HFE codifica una proteína, que se encuentra en la superficie de las células hepáticas e intestinales y en algunas células del sistema inmunitario, encargada de la homeostasis del hierro uniéndose al receptor 1 de transferrina. Además regula la producción de hepcidina que determina cuánto hierro se absorbe de la dieta y se libera de los sitios de almacenamiento en el cuerpo. Dos SNP son responsables de la mayoría de los casos de hemocromatosis hereditaria tipo 1: C282Y y H63D. La variante C282Y evita que la proteína HFE llegue a la superficie celular y se la ha asociado con mayores niveles de transferrina. El SNP H63D altera la forma tridimensional de la proteína. Estas variantes evitan que HFE interactúe con el receptor 1 de transferrina. Como resultado, la regulación del hierro se interrumpe y hay aumento en la abrocion del hierro de la dieta conduciendo a una sobrecarga de hierro. El exceso de hierro se deposita en una variedad de órganos, lo que lleva a su falla y da como resultado desde pigmentación en la piel hasta enfermedades graves como cirrosis, hepatomas, diabetes, cardiomiopatía, artritis y disfunción sexual. Individuos que llevan la/s variante/s del gen pueden no tener síntomas o signos y la enfermedad es tratable si se detecta temprano ya que, los efectos severos de la enfermedad generalmente no aparecen hasta después de décadas de carga progresiva de hierro. |
||||||||||||
| Intolerancia a la lactosa | ||||||||||||||
|
Componente 6 del complejo de mantenimiento de minicromosomas (MCM6) |
-13910C>T |
Una variación no codificante en MCM6 afecta la regulación transcripcional del gen LCT (lactasa) vecino, lo que resulta en una baja regulación de la actividad de la lactasa, por lo tanto el SNP del MCM6 influye en la intolerancia a la lactosa durante la infancia o la adultez temprana. Sin embargo, la mayoría de los europeos del norte y algunas poblaciones africanas tienen la capacidad de mantener la actividad de la lactasa y digerir la lactosa durante toda la vida; esto se conoce como persistencia de la lactasa y se asocia al genotipo CT del gen MCM6. Personas intolerantes a la alctosa, después de la ingestión de leche o productos lácteos pueden experimentar calambres abdominales, hinchazón, distensión, flatulencia y diarrea. |
||||||||||||
| Sensbilidad a la cafeína | ||||||||||||||
| CYP1A2 | C>A | La enzima citocromo P450 1A2 es una de las principales enzimas que metabolizan la cafeína, estimulante del sistema nervioso central y que se usa para reducir la fatiga física. Un determinado polimorfismo (−163C > A) influye en la actividad de CYP1A2. El genotipo se ha asociado de manera diferencial con el efecto de la cafeína en el rendimiento del ejercicio, el riesgo de infarto de miocardio, el sueño y la presión arterial. Las personas con el alelo C tienen una capacidad reducida para metabolizar la cafeína y una ingesta moderada a alta de bebidas con cafeína se asocia con un mayor riesgo de enfermedades del corazón. A estas personas se les denomina "metabolizadores lentos de café". Interesantemente el alelo C ha sido relacionado con un efecto protector para el cáncer de mama. Los individuos que portan el alelo A se llaman "metabolizadores rápidos de café". | ||||||||||||
| Meabolismo PUFA (ácidos grasos poliinsaturados) | ||||||||||||||
|
Acil-CoA (8-3) -desaturasa (FADS1) |
rs174537 G>T |
La Acil-CoA(8-3)-desaturasa participa en la biosíntesis de ácidos grasos altamente insaturados(HUFA) a partir de los ácidos grasos poliinsaturados esenciales (PUFA), el ácido linoleico (LA) y los precursores del ácido alfa-linolénico (ALA). Específicamente, desatura el dihomo-gamma-linoleoato (DGLA) y el eicosatetraenoato (ETA) para generar araquidonato (AA) y eicosapentaenoato (EPA), respectivamente. Como enzima limitante de la velocidad de la biosíntesis de eicosanoides derivada de DGLA y AA controla el metabolismo de los lípidos inflamatorios como la prostaglandina E2, fundamental para la respuesta inflamatoria aguda eficiente y el mantenimiento de la homeostasis del epitelio. Contribuye a la biosíntesis de fosfolípidos de membrana al proporcionar AA como una cadena principal de acilo esterificada en fosfolípidos. En particular, regula los niveles de fosfatidilinositol-4,5-bisfosfato, modulando la producción de citocinas inflamatorias en las células T. Los SNP en FADS se han asociado con alteración en las concentraciones en sangre de PUFA de cadena larga (LC-PUFA), así como de colesterol. El alelo G está asociado con una conversión mejorada de DGLA a AA debido a una mayor eficiencia enzimática y, por lo tanto, parece ser asociado con niveles más altos de AA, inflamación sistémica y trastornos inflamatorios. Los individuos rs174537 (T;T) tienen ácido araquidónico (AA) más bajo, así como niveles más bajos de todos los demás poliinsaturados (excepto el ácido linoleico y el ácido alfa-linoleico), en comparación con (G;G) homocigotos. Mientras que personas que portan al menos un alelo rs174537 (G) tienen niveles más altos de lipoproteína de baja densidad (LDL-C) y colesterol total. Basado en la variación genética, los individuos pueden requerir diferentes cantidades de PUFA o LC-PUFA de la dieta para lograr efectos biológicos comparables. |
||||||||||||
| Sensibilidad a la sal | ||||||||||||||
| ACE | I/D | La enzima convertidora de angiotensina es una enzima clave en la regulación de la presión arterial y afecta la capacidad aeróbica, la fuerza muscular y la masa corporal magra. La variante I está asociada con una menor actividad enzimática y la variante D con mayor actividad enzimática. Los estudios muestran que los pacientes con hipertensión y un genotipo II tuvieron un aumento de la presión arterial significativamente mayor con un alto consumo de sal en comparación con los individuos con DD. | ||||||||||||
| AGT | T>C | El angiotensinógeno es fundamental en la regulación de electrolitos, equilibrio de fluidos corporales y la presión arterial. El genotipo CC de AGT conduce a la vasoconstricción y al aumento de la presión arterial. Sin embargo, la incidencia de hipertensión en individuos con el genotipo CC fue significativamente menor cuando se redujo la ingesta de sodio. | ||||||||||||
| Sensibilidad a la respuesta del sabor amargo | ||||||||||||||
|
Miembro de la familia de rceptores gustativos TAS2R (TAS2R38) |
|
El sabor es un determinante importante de la aceptación o rechazo de los alimentos. Variabilidad interindividual en la sensibilidad al sabor amargo puede influir fuertemente en las preferencias alimentarias, estado nutricional y salud. Los receptores gustativos de tipo TAS1R y TAS2R se expresan en el sistema gustativo, donde detectan estímulos de sabor dulce y amargo, respectivamente. Estos receptores también se expresan en subconjuntos de células dentro del tracto gastrointestinal de mamíferos, donde median la asimilación de nutrientes y las respuestas endócrinas. Hay tres SNP que forman los principales haplotipos detrás de la capacidad de percibir como amargo el sabor del compuesto feniltiocarbamida (PTC) y moléculas similares en alimentos (como el repollo y el brócoli crudo) o bebidas (como el café y las cervezas negras). rs713598, rs1726866 y rs10246939 son los tres SNP que forman los haplotipos de degustación. Los alelos se asignan como "sabor" y "sin sabor" donde sabor es dominante.
|
||||||||||||
| Metabolismo del alcohol | ||||||||||||||
|
Aldehído deshidrogenasa, mitocondrial (ALDH2) |
rs671 G>A |
La aldehído deshidrogenasa 2 (ALDH2) es una enzima que se expresa en las mitocondrias del hígado responsable de la desintoxicación de aldehídos como el acetaldehído derivado de etanol (alcohol), 4-hidroxinonenal y el malondialdehído generado por la peroxidación lipídica. Es por lo tanto, una enzima importante para proteger contra el estrés oxidativo. La variación genética en ALDH2 es responsable de las diferencias individuales en las respuestas al consumo de alcohol ya que afecta la actividad de la enzima. El alelo A rs671 (ALDH2*2) está asociado con una incidencia muy alta de intoxicación aguda por alcohol en orientales y nativos americanos, en comparación con los caucásicos, ya que codifica una forma defectuosa de ALDH2 para metabolizar el alcohol. El rs671 es un SNP clásico, respondable del "sonrojo del alcohol", también conocido como "rubor asiático" porque a personas que siendo bebedores casuales, a menudo de ascendencia asiática, se les ponen rojos su cara, su cuello y hasta los hombros después de beber alcohol. Las personas que poseen una o dos copias muestran respuestas alteradas de sensibilidad al alcohol, incluido el enrojecimiento facial y las resacas graves. 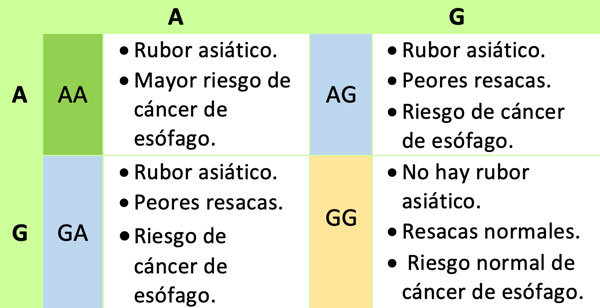
|
||||||||||||
| Intolerancia al gluten | ||||||||||||||
|
La enfermedad celíaca (EC) es un trastorno autoinmune complejo causado por la ingestión de gluten en individuos genéticamente susceptibles. Gluten es el término general para las proteínas alcohol solubles, presentes en varios cereales, incluidos trigo, avena, cebada y centeno. Su causa es multifactorial y los factores dietéticos, ambientales y genéticos tienen una significación importante en su aparición. En pacientes celíacos, la ingestión de gluten conduce a la activación de la respuesta inmune con una inflamación crónica posterior que determina cambios en la estructura de la mucosa intestinal, incluyendo atrofias de las vellosidades e infiltración de linfocitos entre otros, que causan la subsecuente pérdida de función de la mucosa y el inicio de síntomas provocados por la mala absorción de nutrientes. El diagnóstico de la EC es complejo por la diversidad de las manifestaciones clínicas y por su similitud con otras enfermedades del tracto digestivo. Aunque las pruebas serológicas (anticuerpos específicos para EC) y la biopsia intestinal son suficientes para proponer un diagnóstico provisional, el genotipaje HLA-DQ2/DQ8 constituye una prueba confirmatoria útil gracias a su alto valor predictivo negativo. |
||||||||||||||
|
Antígeno Leucocitario Humano HLA-DQA1 HLA-DQB1 |
DQ2/DQ8 |
Los principales determinantes para la susceptibilidad genética son los genes HLA-DQA1 y HLA-DQB1. HLA-DQ es una familia de genes que codifican para un receptor de superficie celular formado por un heterodímero con subunidades α y β codificadas por los genes HLA-DQA1 y HLA-DQB1 respectivamente. Es importante destacar que los genes DQ están asociado con muchas enfermedades autoinmunes9. El término "haplotipo" se utiliza para referirse al conjunto de alelos en un cromosoma que se heredan juntos. Entonces, los distintos alelos del gen HLA-DQA1 y los dintsitntos alelos del gen HLA-DQB1 se combinan y forman haplotipos que codifcan finalmente para los "antígenos leucocitarios humanos o antigenos HLA", que se denominan igual que el haplotipo 10. 

La segunda variante, HLA-DQ2.2, se hereda conjuntamente con el HLA-DR7. Pese a que esta molécula es homóloga a la molécula HLA-DQ2.5 no predispone de igual manera a la Enfermedad Celíaca. Los individuos que expresan este haplotipo DR7-DQ2.2 (A1*0201/B1*0202) y el haplotipo DR5-DQ7 (A1*0505/B1*0301) tienen altas probabilidades de padecer la enfermedad. Esto se basa en que poseen el alelo HLADQ2.5 (A1*05/B1*02) en configuración trans. Esta observación sugiere que una variación en la cadena α del alelo HLA-DQ2 representa un riesgo considerable de padecer la enfermedad. La mayoría de los pacientes HLA-DQ2 negativos (del 5 al 10 % restante) presenta el heterodímero HLA-DQ8. Esta molécula está en configuración cis con el alelo DR4 y se la ha visto asociada con la diabetes mellitus tipo 1. La presencia de los alelos de susceptibilidad influye en el fenotipo de la enfermedad. La condición de homocigoto para el HLA-DQ2.5 determina una presentación temprana de EC, mayor producción de anticuerpos y complicaciones sistémicas, además de niveles superiores de citoquinas proinflamatorias. Se puede resumir el riesgo asociado a EC de la siguiete manera, conforme a la herencia de los padres: 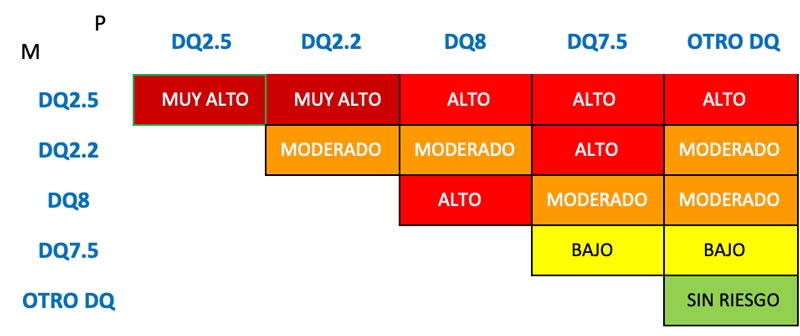
|
||||||||||||
| METABOLISMO DE LAS VITAMINAS | ||||||||||||||
| Vitamina A | ||||||||||||||
|
Betacaroteno (mono) oxigenasa 1 BCO1 /BCMO1 |
G > T |
El β-caroteno es el carotenoide provitamina A más abundante en la dieta y, una vez absorbido, se convierte en diferentes metabolitos. La enzima responsable de la conversión de β-caroteno en retinol (vitamina A) es la β-caroteno 15,15′-monoxigenasa (BCMO1), y ∼95% de los retinoides que surgen del β-caroteno son producidos por esta vía in vivo. Usa al hierro como cofactor. Los estudios en un modelo de ratón knockout para BCMO1 han proporcionado más evidencia del papel fundamental de esta enzima en la producción de vitamina A a partir de β-caroteno en la dieta. BCMO1 es una enzima citosólica soluble que muestra la mayor actividad en la mucosa intestinal, específicamente en los enterocitos yeyunales. También se encuentran niveles elevados de ARNm de BCMO1 en el hígado, pulmón y riñón, y niveles más bajos en el cerebro, próstata, ovario, colon y músculo esquelético, lo que sugiere la importancia de la síntesis local de vitamina A. El alelo G conduce a una disminución en la actividad de la enzima BCO1 12. Los portadores del genotipo GT se han asociado con mayores niveles de provitamina A en el suero que los portadores GG a quienes se les recomienda una mayor ingesta de alimentos ricos en B-caroteno más suplementación. |
||||||||||||
| rs7501331 C>T Ala379Val |
En portadores de la variante T de rs7501331 (379V) se observó una disminución en la actividad del 32% para convertir β -caroteno. El genotipo CC representa una actividad normal para la enzima. | |||||||||||||
| Vitamina D | ||||||||||||||
|
La vitamina D es un modulador del sistema inmune 13. La genética contribuye sustancialmente a determinar el metabolismo de la vitamina D. Varios estudios han mostrado asociaciones significativas entre polimorfismos de genes implicados en el metabolismo de la vitamina D y su deficiencia. La misma se ha asociado con múltiples enfermedades, como la osteoartritis, debilidad muscular, retraso del crecimiento y deformidades esqueléticas en niños y precipita la osteoporosis con riesgo de fractura en la edad avanzada. Su insuficiencia,además de la salud ósea, se ha implicado en la diabetes tipo 1 y también en enfermedades cardiovasculares. La vitamina D, en cualquiera de sus dos formas (ergocalciferol o vitamina D2, colecalciferol o vitamina D3), es inactiva y, para ejercer sus funciones biológicas, necesita ser activada a su forma hormonal, a través de dos hidroxilaciones sucesivas. La primera hidroxilación tiene lugar en el hígado, donde la vitamina D se convierte en 25-hidroxivitamina D 25(OH)D, también llamada calcidiol, que es el metabolito que circula en mayor concentración, y cuya medición en el plasma se emplea para estimar el estado de vitamina D del individuo. La segunda hidroxilación tiene lugar tanto en el riñón como en numerosas células no renales que convierten la 25(OH)D en la 1,25-dihidroxivitamina D (también denominada calcitriol), la vitamina D hormona y, por tanto, el metabolito natural más activo que puede unirse y a su vez activar al receptor de vitamina D (VDR). La 25-hidroxivitamina D puede unirse al VDR y activarlo, pero con una afinidad, al menos, 200 veces inferior a la del calcitriol. La activación del VDR entonces inicia la maquinaria genética celular para producir los genes necesarios para mantener la homeostasis mineral, la integridad del esqueleto y, también, acciones renoprotectoras y cardioprotectoras que aumentan la supervivencia 14. |
||||||||||||||
| CYP2R1 | rs 10741657 A > G |
CYP2R1 se expresa en el hígado y codifica la enzima 25-hidroxilasa, que participa en la primera de las dos reacciones (la conversión de vitamina D a 25(OH)D o calcidiol) que convierten la vitamina D a su forma activa calcitriol. El SNP rs10741657 ha sido vinculado a las concentraciones séricas de vitamina D15. El alelo A se asoció con un aumento de los niveles de 25(OH)D mientras que el alelo G está asociado con concentraciones más bajas de vitamina D. Los portadores (G;G) tienen una vitamina D más baja que los portadores de un alelo, que a su vez tienen niveles más bajos de vitamina D que los individuos (A;A) quienes tienen una capacidad enzimática mejorada para convertir calcidiol en calcitriol. |
||||||||||||
|
Componente Específico de Grupo/ Proteína de unión a la vitamina D ) GC-VDBP |
• rs 7041 1296 T > G Asp432(416)Glu • rs 4588 C > A Thr 436(420) Lys • rs2282679 T > G |
La proteína de unión a la vitamina D (VDBP), codificada por el gen componente específico de grupo (GC) que pertenece a la familia de genes de albúmina, es una proteína multifuncional que se encuentra en el plasma, el líquido ascítico, el líquido cefalorraquídeo y en la superficie de muchos tipos de células. Se une a la vitamina D y sus metabolitos plasmáticos y los transporta a los tejidos diana. La presencia o ausencia de SNPs en el gen GC, puntualmente rs7041 (1296 T>G), rs4588 (C>A), y rs 2282679 (T>G) conduce a proteínas VDB con características ligeramente diferentes que tienen un efecto sobre los niveles circulantes de vitamina D15. (Cabe mencionar que el rs4588 no se analiza en DNA Health). Rs2282679 (G) está asociado con bajas concentraciones de vitamina D (25[OH]D) 16. rs7041 (T), es el alelo mayor, el más común en muchas poblaciones no caucásicas o hispanas, y codifica un ácido aspártico (Asp) en la posición 432 de VDBP (en la literatura anterior, esto se numera como la posición 416); rs7041 (G) es el alelo más raro y codifica un ácido glutámico (Glu) en esta posición. Rs4588 (C) es el alelo común que codifca para treonina (Thr) en la posición 436 (antes 420); el alelo (A) es el alelo menor y codifica para una lisina (Lys). La combinación de los SNPs que conduce a cada una de las formas de las proteínas VDP son: -Gc1f (1f): rs7041 (T) + rs4588 (C) -Gc1s (1s): rs7041 (G) + rs4588 (C) -Gc2 (2): rs7041 (T) + rs4588 (A) Dado que una persona normalmente tiene dos copias del gen GC, esto conduce a seis posibles fenotipos VDBP (o haplotipos) que influyen en la cantidad de vitamina D que circula en la sangre, es decir, los niveles séricos de 25(OH)D 17. Los niveles de Vitamina D se asocian a los haplotipos, de la siguiente manera: 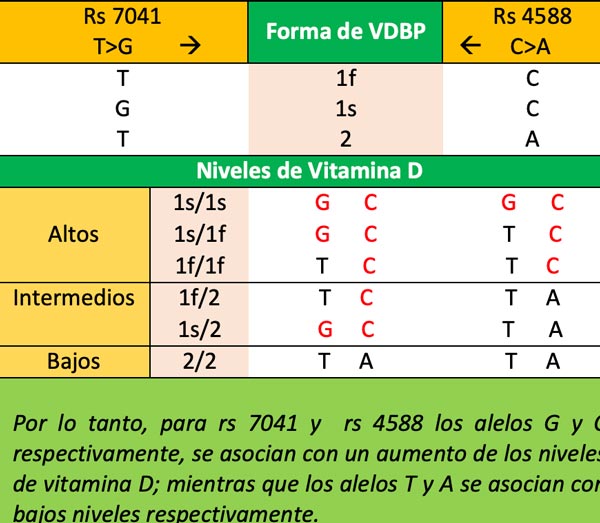
|
||||||||||||
| Vitamina B12 | ||||||||||||||
| La vitamina B12 (cobalamina) es producida únicamente por las bacterias y archaeas; la única fuente natural de esta vitamina son alimentos de origen animal como carne, pescado, huevos y productos lácteos. En humanos, la vitamina B12 funciona como una coenzima esencial en diversas funciones celulares como metabolismo energético, síntesis de ADN y metilación, así como la síntesis de proteínas, lípidos y carbohidratos. La deficiencia de vitamina B 12 (ya sea por baja ingesta o polimorfismos en genes implicados en su absorción y el transporte intracelular) se ha asociado con varias enfermedades complejas. | ||||||||||||||
|
Fucosiltransferasa 2 FUT2 |
rs 602662 772 G>A Gly258Ser |
FUT2 codifica para la enzima fucosiltransferasa 2, que participa en la absorción y en el transporte de la vitamina B12. El SNP de FUT2 rs602662 772 G>A se asoció significativamente con los niveles de vitamina B 1220,21. El genotipo (A;A) se coresponde con niveles más altos de vitamina B12 y el genotipo (G;G) con niveles más bajos. De modo que para portadores (G;G) aumenta el riesgo de anemia, condiciones neurológicas, resistencia a la insulina y metabolismo alterado de la homocisteína con trastornos cardiovasculares. Estos individuos deben aumentar el consumo de vitamina B12 a través de los alimentos ( carne, pescado, aves y huevos) o mediante suplementos. Por lo tanto, una dieta vegetariana junto con el polimorfismo en el gen FUT2 puede contribuir significativamente a la alta deficiencia de vitamina B 12. | ||||||||||||
| Vitamina C | ||||||||||||||
| GSTT1 | Inserción / Deleción | GSTT1 codifica para un miembro de la familia del glutatión S-transferasa (GSTT1), que son enzimas desintoxicantes que contribuyen al ciclo antioxidante glutatión- ácido ascórbico (vitamina C). La vitamina C, un antioxidante esencial y que ayuda a reducir la producción de los radicales libres, y el glutatión (GSH) están bioquímicamente relacionados. GSH recicla activamente el deshidroascorbato oxidado de nuevo a ascorbato y la deficiencia de GSH se acompaña de niveles bajos de ascorbato en los tejidos 8. El gen GSTT1 está ausente en el 38% de la población y esta deleción está asociada con un mayor riesgo de cáncer de pulmón, laringe y vejiga, así como con carcinomas basales de la piel. La presencia del gen protege contra la deficiencia de vitamina C de la dieta. | ||||||||||||
Bibliografía:
- Jocelyn E. Krebs, Elliott S. Goldstein, Stephen T. Kilpatrick. "Lewin's GENES XI", Ed: Jones and Bartlett Publishers, Inc; (2012).Edición: 11 Rev ed.
- Eleftheria Zeggini, Anna L. Gloyn, Anne C. Barton, Louise V. Wain. "Translational genomics and precision medicine: Moving from the lab to the clinic"Science, 27 Sep 2019: Vol. 365, Issue 6460, pp. 1409-1413 DOI: 10.1126/science.aax4588.
- Kullo IJ, Fan X, Ding K. "Genetic Risk, Lifestyle, and Coronary Artery Disease". N Engl J Med. (2017) Mar 23;376(12):1192-3. doi: 10.1056/NEJMc1700362)
- Rutten-Jacobs LC, Larsson SC, Malik R, Rannikmäe K, MEGASTROKE consortium; International Stroke Genetics Consortium, Sudlow CL, Dichgans M, Markus HS, Traylor M. "Genetic risk, incident stroke, and the benefits of adhering to a healthy lifestyle: cohort study of 306 473 UK Biobank participants". BMJ. (2018) Oct 24;363:k4168. doi: 10.1136/bmj.k4168).
- Sparks JA, Iversen MD, Yu Z, Triedman NA, Prado MG, Miller Kroouze R, Kalia SS, Atkinson ML, Mody EA, Helfgott SM, Todd DJ, Dellaripa PF, Bermas BL, Costenbader KH, Deane KD, Lu B, Green RC, Karlson EW. "Disclosure of Personalized Rheumatoid Arthritis Risk Using Genetics, Biomarkers, and Lifestyle Factors to Motivate Health Behavior Improvements: A Randomized Controlled Trial". Arthritis Care Res (Hoboken. (2018 )Jun;70(6):823-833. doi: 10.1002/acr.23411. Epub 2018 Apr 16.
- Ariel B. Ganz, Kelsey Shields, Vlad G. Fomin, Yusnier S. Lopez,,et al. Genetic impairments in folate enzymes increase dependence on dietary choline for phosphatidylcholine production at the expense of betaine synthesis. FASEB J. 2016 Oct;30(10):3321-3333. Epub 2016 Jun 24.
- Daniela Neagos, Ruxandra Cretu, Andreea Tutulan-Cunita, Veronica Stoian et al. Methylenetetrahydrofolate dehydrogenase (MTHFD) enzyme polymorphism as a maternal risk factor for trisomy 21: a clinical study. Journal of Medicine and Life Vol. 3, No.4, October‐December 2010, pp.454‐457
- Gould, Rebecca L, and Robert Pazdro. "Impact of Supplementary Amino Acids, Micronutrients, and Overall Diet on Glutathione Homeostasis." Nutrients vol. 11,5 1056. 11 May. 2019, doi:10.3390/nu11051056
- Ruiz-Ortiz E, Montraveta M, Cabré E, et al. HLA-DQ2/DQ8 and HLA-DQB1*02 homozygosity typing by real-time polymerase chain reaction for the assessment of celiac disease genetic risk: evaluation of a Spanish celiac population. Tissue Antigens. 2014;84(6):545–553. doi:10.1111/tan.12472
- Martina Sciurti, Fabiola Fornaroli, Federica Gaiani, Chiara Bonaguri et al. Genetic susceptibilty and celiac disease: what role do HLA haplotypes play? Acta Biomed 2018; Vol. 89, Supplement 9: 17-21 DOI: 10.23750/abm.v89i9-S.7953
- Núñez C, Garrote JA, Arranz E, et al. Recommendations to report and interpret HLA genetic findings in coeliac disease. Rev Esp Enferm Dig. 2018;110(7):458–461. doi:10.17235/reed.2018.5269/2017
- W. C. Leung, S. Hessel, C. Méplan, J. Flint, et al. Two common single nucleotide polymorphisms in the gene encoding β-carotene 15,15′-monoxygenase alter β-carotene metabolism in female volunteers. The FASEB Journal 2009 23:4, 1041-1053
- Morán-Auth Y, Penna-Martinez M, Shoghi F, Ramos-Lopez E, Badenhoop K. Vitamin D status and gene transcription in immune cells. J Steroid Biochem Mol Biol. 2013;136:83–85. doi:10.1016/j.jsbmb.2013.02.005
- A.S. Dusso. El sistema hormonal de la vitamina D: lo que sabemos y lo que nos queda por saber. Nefrología Sup Ext 2011;2(5):37-43. doi:10.3265/NefrologiaSuplementoExtraordinario.pre2011.Jul.11071
- Janna Nissen, Ulla Vogel, Gitte Ravn-Haren, Elisabeth W Andersen, et al. Common variants in CYP2R1 and GC genes are both determinants of serum 25-hydroxyvitamin D concentrations after UVB irradiation and after consumption of vitamin D3–fortified bread and milk during winter in Denmark, The American Journal of Clinical Nutrition, Volume 101, Issue 1, January 2015, Pages 218–227, https://doi.org/10.3945/ajcn.114.092148
- Wenli Song, Xian’e Wang, Yu Tian, Xin Zhang et al. GC Gene Polymorphisms and Vitamin D-Binding Protein Levels Are Related to the Risk of Generalized Aggressive Periodontitis. Internactional Journal of Endocrinology. Volume 2016 |Article ID 5141089 | https://doi.org/10.1155/2016/5141089
- Jorde R, Schirmer H, Wilsgaard T, et al. The DBP Phenotype Gc-1f/Gc-1f Is Associated with Reduced Risk of Cancer. The Tromsø Study. PLoS One. 2015;10(5):e0126359. Published 2015 May 18. doi:10.1371/journal.pone.0126359
- Cheung, C., Lau, K., Sham, P. et al. Genetic variant in vitamin D binding protein is associated with serum 25-hydroxyvitamin D and vitamin D insufficiency in southern Chinese. J Hum Genet 58, 749–751 (2013). https://doi.org/10.1038/jhg.2013.84
- Janssens W, Bouillon R, Claes B, et al. Vitamin D deficiency is highly prevalent in COPD and correlates with variants in the vitamin D-binding gene. Thorax. 2010;65(3):215–220. doi:10.1136/thx.2009.120659
- Hazra A, Kraft P, Selhub J, et al. Common variants of FUT2 are associated with plasma vitamin B12 levels. Nat Genet. 2008;40(10):1160–1162. doi:10.1038/ng.210
- Tanwar VS, Chand MP, Kumar J, et al. Common variant in FUT2 gene is associated with levels of vitamin B(12) in Indian population. Gene. 2013;515(1):224–228. doi:10.1016/j.gene.2012.11.021
- https://www.ncbi.nlm.nih.gov
- https://www.uniprot.org
- https://www.ncbi.nlm.nih.gov/SNP
- http://www.ensembl.org/Homo_sapiens/Variation
- https://www.ebi.ac.uk/gwas/
- https://ghr.nlm.nih.gov/gene
- https://www.snpedia.com
- https://rarediseases.info.nih.gov
- https://www.genecards.org
- https://www.weizmann.ac.il







